产品开发
我们的目标是:
帮助我们的客户实现改变生活的想法。
全球足迹
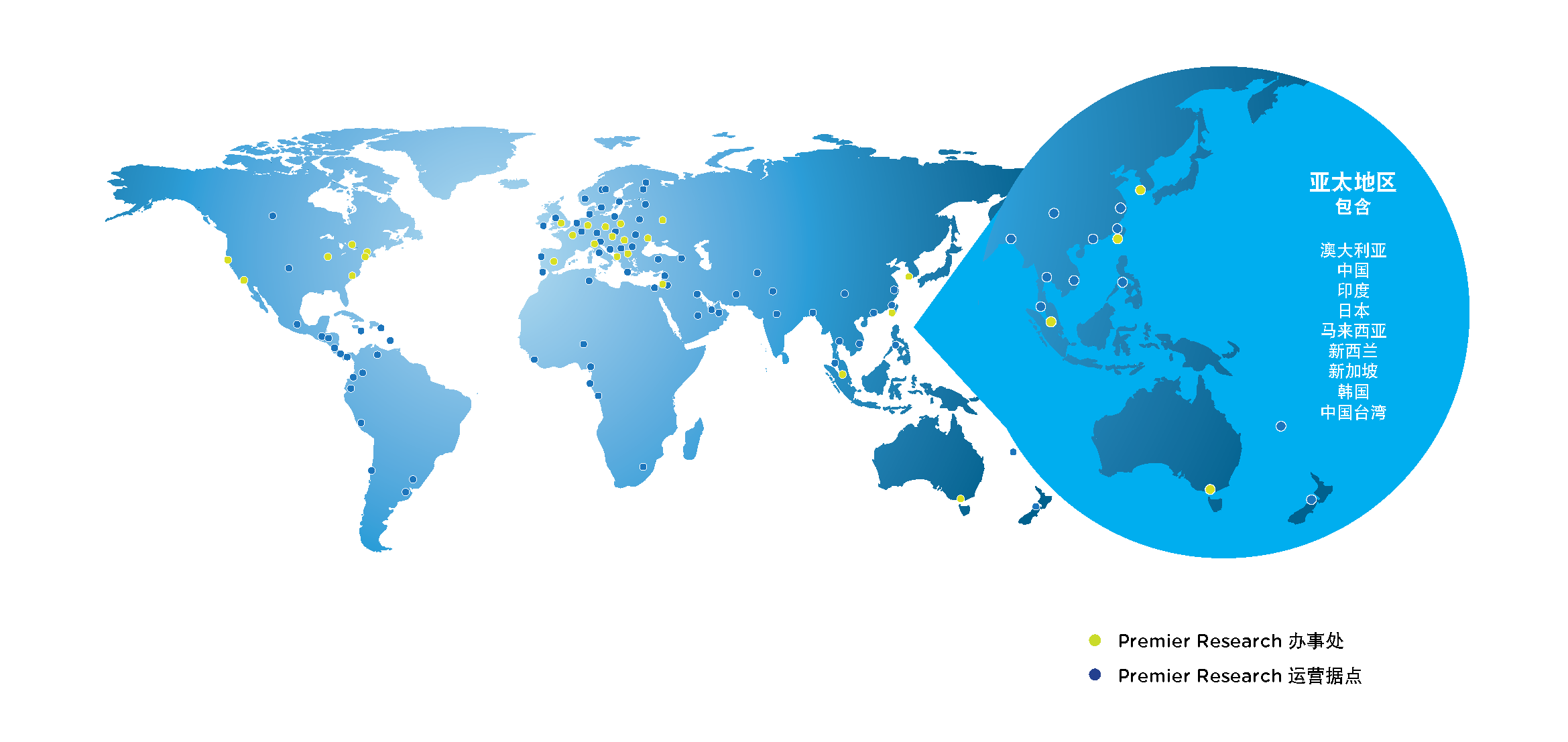
业务遍布全球
在亚太地区、欧洲、中东和北美设有 25 个办事处
运用我们丰富的专业经验助您成功
我们将专业治疗知识集中运用于最具突破性的研发中药物。
既往五年开展了
- 170+ 血液瘤和肿瘤学临床研究
- 190+ 罕见病临床研究
- 180+ 儿科相关临床研究
- 90+ 皮肤病学临床研究
- 28+ 纤维肌痛临床研究
- 170+ 医疗器械临床研究
- 239+ 镇痛临床研究

探索我们全面的服务选择
注册咨询
1 – 3 期临床研究
探索研究和注册性研究
研究设计
统计分析
数据管理
基于风险的监查策略
安全性/药物警戒
质量管理
患者参与
疾病自然史研究
后期临床研究
上市后监测
注册登记
真实世界研究
全球监管咨询
从 IND 前阶段到市场准入,我们可在整个开发生命周期中提供战略和运营解决方案。
- 缺陷型分析
- 临床开发计划
- 孤儿药申请
- 突破性疗法和快速通道
- 监管和风险审查
- 全球法规和指南
- 医疗和监管事务
- 监管申报和管理
- 非临床服务(毒理学、POC)
- CMC 专家 (GMP)
- 上市许可支持
每年平均 20 多次代理会议

ePremier 技术平台
数据收集
- 交互式应答技术 (IRT)
- 电子数据采集 (EDC)
- 研究启动
质量监督
- 基于风险的质量管理平台
- 实时访问研究指标
- 过程中分析和报告
试验管理
- 临床研究者付款
- 电子试验主文件 (eTMF)
- 安全性数据库
- 招募预测模型 (RPM)





